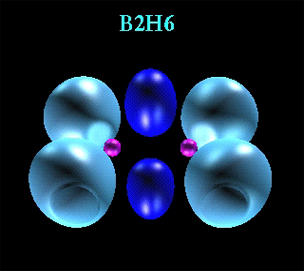|
شیمی2 |
|||||||||||||
|
سه شنبه 2 اسفند 1390برچسب:, :: 17:0 :: نويسنده : mahyar yari
این درس شامل 5 بخش است 1 : ساختار اتم ، از آنجایی که دانش آموز به تازگی از شیمی 1 رها شده و در کلاس شیمی 2 با نظریات اتمی نشسته ، شایسته است که قدری این بخش را عمیق تر و موشکافانه تر بررسی کنیم 2 – جدول تناوبی ، همان طور که از اسمش برمیاد ، تسلط بر جدول تناوبی می تونه این بخس را برای ما جذاب تر کند . 3 – ترکیب های یونی ، هیچی نگم . برید سراغ کتاب درسی 4 – ترکیب های کووالانسی ، اکثرا بچه ها از این بخش ناله دارند . ولی نباید این طور باشه . به قول بچه های کنکوری ، تمام بخش 4 با یک فرمول n حل میشه . باید دید که فرمول n چی هست !!!!!!!!! 5- ترکیب های آلی . شیمی آلی که خیلی مظلوم و فقیر واقع شده است . سعی کنید که در همین سال دوم تکلیف شیمی 2 را هم برای کنکور و هم برای المپیاد معلوم کنید . بعدا برای شما وقت گیر و دردسر ساز خواهد شد ……………… پیوند هیدروژنی وقتي اتم هيدروژن به دو يا چند اتم ديگر پيوند شده باشد، يک پيوند هيدروژني وجود دارد. اين تعريف اشاره بر اين دارد که پيوند هيدروژني نميتواند يک پيوند کووالانسي عادي باشد، زيرا اتم هيدروژن تنها يک اوربيتال (1S) در سطح انرژي به قدر کافي پايين دارد که درگير تشکيل پيوند کووالانسي شود جاذبه ي بين مولکولي و پيوند هيدروژني :جاذبه بين مولکولي در برخي از ترکيبات هيدروژندار بطور غير عادي قوي است. اين جاذبه در ترکيباتي مشاهده ميشود که در آنها بين هيدروژن و عناصري که اندازه کوچک و الکترونگاتيوي زياد دارند، پيوند هيدروژني وجود دارد. در اين ترکيبات ، اتم عنصر الکترونگاتيو چنان جاذبه شديدي بر الکترونهاي پيوندي اعمال ميکند که در نتيجه آن ، هيدروژن داراي بار مثبت قابل ملاحظه +δ ميگردد. هيدروژن در اين حالت ، تقريبا به صورت يک پروتون بيحفاظ است، زيرا اين عنصر فاقد الکترون پوششي است. اتم هيدروژن يک مولکول و زوج الکترون غير مشترک مولکول ديگر ، متقابلا همديگر را جذب ميکنند و پيوندي تشکيل ميشود که به پيوند هيدروژني مرسوم است. هر اتم هيدروژن قادر است تنها يک پيوند هيدروژني تشکيل دهد. نقطه جوش و پيوند هيدروژني : ترکيباتي که پيوند هيدروژني دارند، خواص غير عادي از خود نشان ميدهند. تغييرات نقاط جوش در مجموعه ترکيبات SnH4 , GeH4 , SiH4 , CH4 مطابق روال پيش بيني شده براي ترکيبات است نيروهاي بين مولکولي آنها منحصر به نبروهاي لاندن است. نقطه جوش در اين مجموعه با افزايش اندازه مولکولي ، زياد ميشود. ترکيبات هيدروژني عناصر گروه چهار اصلي ، مولکولهاي ناقطبي هستند. اتم مرکزي هر مولکول فاقد زوج الکترون غير مشترک است. در گروههاي پنج ، شش و هفت اصلي نيروهاي دو قطبي – دوقطبي به نيروهاي لاندن در چسباندن مولکولها به يکديگر کمک ميکند. ولي نقطه جوش نخستين عنصر هر مجموعه (NH3,H2O , HF) بطور غير عادي بالاتر از نقاط جوش ساير اعضاي آن مجموعه است. پيوند هيدروژني در هر يک از اين سه ترکيب ، جدا شدن مولکولها را از مايع مشکلتر ميکند. ساير خواص غير عادي مربوط به پيوند هيدروژني : ترکيباتي که مولکولهاي آنها از طريق پيوند هيدروژني به همديگر پيوستهاند، علاوه بر دارا بودن نقاط جوش بالا ، بطور غيرعادي در دماي بالا ذوب ميشوند و آنتالپي تبخير ، آنتالپي ذوب و گرانروي آنها زياد است. شرایط تشکيل پيوند هيدروژني قوي: مولکولي که پروتون را براي تشکيل پيوند هيدروژني در اختيار ميگذارد (مولکول پروتون دهنده) بايد چنان قطبيتي داشته باشد که بار +δ اتم هيدروژن نسبتا زياد باشد. افزايش قدرت پيوند هيدروژني به ترتيب N-H…..N<="" span=""> اتم مولکول پروتون گيرنده که زوج الکترون لازم براي تشکيل پيوند هيدروژني را در اختيار ميگذارد، بايد نسبتا کوچک باشد. پيوند هيدروژني واقعا موثر يا قوي فقط در ترکيبات فلوئور ، اکسيژن و نيتروژن تشکيل ميشوند. ترکيبات کلر پيوند هيدروژني ضعيف تشکيل ميدهند و اين خصلت ، با توجه به تغيير جزئي نقطه جوش HCl پيداست. الکترونگاتيوي کلر تقريبا با نيتروژن برابر است. ولي چون اتم کلر بزرگتر از اتم نيتروژن است، پراکندگي ابر الکتروني در اتم کلر بيش از اتم نيتروژن ميباشد مقايسه پيوند هيدروژني در آب و هيدروژن فلوئوريد : تاثير پيوند هيدروژني به نقطه جوش آب بيش از هيدروژن فلوئوريد است. اگر چه قدرت پيوند O−H…O در حدود 2.3 قدرت پيوند F_H…F است، ولي تاثير فوق مشاهده ميشود. بطور متوسط ، تعداد پيوندهاي هيدروژني به ازاي هر مولکول در H2O دو برابر آن در HF است. اتم اکسيژن در هر مولکول آب ، با دو اتم هيدروژن پيوند دارد و داراي دو زوج الکترون آزاد غير مشترک است. اتم فلوئور در مولکول هيدروژن فلوئوريد ، سه زوج الکترون آزاد دارد که ميتوانند با اتمهاي هيدروژن پيوند تشکيل دهند ولي فقط داراي يک اتم هيدروژن است که ميتواند با ان پيوند هيدروژني تشکيل دهد. پيوند هيدروژني و يخ : پيوند هيدروژني در آب به مقدار خيلي زياد بر روي ساير خواص آن نيز تاثير ميگذارد. آرايش چهار وجهي اتمهاي هيدروژن و زوج الکترونهاي غير مشترک اکسيژن در آب ، سبب ميشوند که پيوندهاي هيدروژني بلور يخ داراي چنين آرايشي باشد و منبع به ساختار گشوده بلور يخ ميشوند. به همين علت چگالي يخ نسبتا کم است. در نقطه انجماد آب ، مولکولها به هم نزديکترند و به همين علت و بطور غير متعارف چگالي آب بيشتر از چگالي يخ است. بايد توجه داشت که مولکولهاي H2O در حالت مايع توسط پيوندهاي هيدروژني به هم پيوستهاند ولي ميزان اين پيوستگي و استحکام آن در حالت مايع کمتر از جامد (يخ) است. پيوند هيد روژني و انحلال پذيري ترکيبات مختلف : با توجه به پيوند هيدروژني ميتوان انحلال پذيري غير منتظره برخي ترکيبات حاوي اکسيژن ، نيتروژن و فلوئور را در برخي حلالهاي هيدروژندار بويژه آب ، توجيه کرد. مثلا آمونياک (3NH) و متانول (CH3 OH) با تشکيل پيوندهاي هيدروژني در آب حل ميشوند. علاوه بر اين ، برخي آنيونهاي اکسيژندار (مانند يون سولفات ، 42+SO) ، با تشکيل پيوند هيدروژني در آب حل ميشوند. نقش پيوند هيدروژني در سيستم هاي زنده : پيوند هيدروژني در تعيين ساختار و خواص مولکولهاي سيستمهاي زنده نقش اساسي دارد. اجزاي مارپيچ آلفا در ساختار پروتئينها و اجزاي مارپيچ دوگانه در ساختمان DNA توسط پيوند هيدروژني به هم ميپيوندند تشکيل و گسسته شدن پيوندهاي هيدروژني در تقسيم ياخته و سنتز پروتئينهاي آن داراي اهميت اساسي است. کشش سطحي : حتما تاکنون ايستادن حشرات را در سطح آب رودخانهها ديدهايد. علت اين امر و پيوند هيدروژني بين مولکولهاي آب سطح رودخانه و ايجاد کشش سطحي و در نتيجه يک لايه به هم پيوسته و تور مانند در سطح آب است که وزن پاهاي نازک حشرات را ميتواند تحمل کند. نحوه تشکيل پيوند هيدروژني : پيوند هيدروژني بر اثر جاذبه اتم هيدروژن جزئي مثبت موجود در يک مولکول و اتم بسيار الکترونگاتيو (F,O,N) موجود در مولکول ديگر توليد مي گردد. قويترين پيوندهاي هيدروژني در سيستم هايي تشکيل مي شوند که در آنها هيدروژن به الکترونگاتيوترين عناصر پيوند شده باشد. جا به جا شدن يک جفت الکترون به سمت عنصر بسيار الکترونگاتيو نيتروژن، اکسيژن يا فلوئوري موجب مي شود که اين اتمها داراي بار منفي جزئي شوند. در اين صورت پيوند هيدروژني پلي است ميان دو اتم شديداً الکترونگاتيو با يک اتم هيدروژن که از طرفي به طور کووالانسي با يکي از اتمهاي الکترونگاتيو و از طرف ديگر به طور الکترواستاتيکي(جاذبه مثبت به منفي) با اتم الکترونگاتيو ديگر پيوند يافته است. استحکام پيوند هيدروژني يک دهم تا يک پنجاهم قدرت يک پيوند کووالانسي متوسط است. شرايط تشکيل پيوند هيدروژني : بالا بودن الکترونگاتيوي اتمهاي متصل به هيدروژن: بر همين اساس است که فلوئور (الکترونگاتيوترين عنصر)، قويترين پيوند هيدروژني و اکسيژن (الکترونگاتيوتر از نيتروژن)، پيوند هيدروژني قويتري در مقايسه با نيتروژن تشکيل مي دهد. همچنين بار مثبت زياد بر روي اتم هيدروژن، زوج الکترون مولکول ديگر را به شدت جذب مي کند و کوچک بودن اندازه اتم هيدروژن سبب مي شود که مولکول دوم بتواند به آن نزديک شود. کوچک بودن اتمهاي متصل به هيدروژن: پيوند هيدروژني واقعاً موثر فقط در ترکيبات فلوئور، اکسيژن و نيتروژن تشکيل مي شود. توجيه خواص غير عادي برخي از مواد : وجود خواص غير عادي برخي از مواد در حالت جامد يا مايع از جمله بالا بودن دماهاي ذوب و جوش، نشان مي دهد که نيروي جاذبه بين مولکولي در آنها به اندازه اي زياد است که نمي توان آن را به تاثيرهاي متقابل ضعيف بين مولکولي نسبت داد. آشناترين اين نوع مواد، فلوئوريد هيدروژن، آب و آمونياک است که بسياري از خواص آنها از جمله دماهاي جوش و ذوب آنها از دماهاي جوش و ذوب ترکيبهاي مشابه خود، براي مثال PH3-H2S-HCL به طور غير منتظره اي بالاتر است. شايد تصور شود که علت اين وضعيت غير عادي، قطبيت به نسبت زياد اين مولکولهاست. البته تا اندازه اي همين طور است. اما بررسي دقيق اين پديده غير عادي نشان مي دهد که بايد نيروي جاذبه قويتر از نيروهاي جاذبه دو قطبي- دو قطبي بين مولکولهاي آنها برقرار باشد. اگر به ساختار الکتروني مولکولهاي NH3-H2O-HF توجه شود، مي توان به موردهاي مشترک بين آنها پي برد. اين وجه اشتراک، وجود دست کم يک پيوند کووالانسي با اتم هيدروژن و يک اوربيتال هيبريدي ناپيوندي دو الکتروني اتم مرکزي بسيار الکترونگاتيو در هر يک از آنهاست. اتمهاي (F,O,N) الکترونگاتيوي بالايي دارند. جفت الکترون ناپيوندي و قابل واگذاري روي اتم الکترونگاتيو H، اين امکان را پديد مي آورد که اتم هيدروژن در نقش پل، اتم هاي الکترونگاتيو دو مولکول را به يکديگر متصل کند و نيروي جاذبه بين مولکولي به وجود مي آيد که به پيوند هيدروژني مرسوم است. خواص ترکيبات داراي پيوند هيدروژني : ترکيباتي که مولکولهاي آنها از طريق پيوند هيدروژني به همديگر پيوسته اند، علاوه بر دارا بودن نقاط جوش بالا، به طور غير عادي در دماي بالا ذوب مي شوند و آنتالپي ذوب و گرانروي آنها زياد است. علت شناور بودن يخ: يخ روي آب شناور مي ماند زيرا به هنگام انجماد منبسط مي شود سبب اين انبساط پيوند هيدروژني ميان مولکول هاي خميده آب است. ساختار خميده مولکول آب ناشي از آرايش چهار وجهي چهار جفت الکترون در لايه ظرفيت يک اتم است. ساختار زاويه اي مولکول آب و پيوند هيدروژني ميان مولکولهاي آب به آن معني است که هر مولکول آب مي تواند حداکثر با چهار مولکول آب ديگر پيوند هيدروژني داشته باشد. پس آب مايع را مي توان به صورت خوشه هايي از مولکولهاي آب تصور کرد،خوشه هايي که با پيوند هيدروژني از مولکولهاي آب ساخته شده اند و دائم در حال حرکتند. شمار مولکولها در هر خوشه و سرعت حرکت خوشه ها به دما بستگي دارد. با سرد شدن آب، مجموعه هايي از مولکولهاي آب که سرعت در حرکت اند، کند مي شوند و در نقطه انجماد به يکديگر قلاب شده ساختمان سه بعدي منبسط شده اي را به وجود مي آورند. اين ساختمان گسترده تر موجب مي شود که تراکم يخ کمتر از آب باشد. ذوب شدن يخ در حدود 15% انرژي پيوندهاي هيدروژني را مي شکند و اين امر سبب فرو ريختن ساختار مي شود. در نتيجه مايعي متراکم حاصل مي گردد. چرا نقطه جوش آب بالا است؟ خاصيت عجيب ديگر آب، نقطه جوش نسبتاً زياد آن است. تقريباً تمام ترکيبات هيدروژن دار مجاور اکسيژن و اعضاي خانواده آن يعني CH4-NH3-H2S-H2Se-H2Te-PH3-HCL در دماي اتاق به حالت گازي هستند. اما آب مايع است. براي آنکه يک مولکول به حالت بخار در آيد، بايد انرژي جذب کند تا بتواند خود را از قيد مولکولهاي ديگر آزاد کند. چون آب مايع با پيوند هيدروژني به صورت خوشه هايي از مولکول ها در مي آيد، براي شکسته شدن پيوندهاي هيدروژني آن، انرژي زياد لازم است. اما همه پيوندهاي هيدروژني شکسته نمي شوند و خوشه هايي از مولکولهاي آب حتي در نزديکي 1000 درجه سانتيگراد هنوز وجود دارند. وقتي آب گرم مي شود، آشفتگي گرمايي پيوند هيدروژني را مي گسلد تا آنکه در بخار آب، فقط جزء کوچکي از شمار پيوندهاي هيدروژني موجود در آب مايع يا جامد باقي مي ماند. اگر پيوند محکم ميان مولکولي از قبيل پيوند هيدروژني وجود نداشته باشد، مواد معمولاً بنا به جرم مولکولي خود به جوش مي آيند. جرم هاي مولکولي بزرگتر براي جوش آمدن به دماي زيادتري نيازمندند. عمدتاً به اين دليل که ابرهاي الکتروني بزرگتر آسانتر واپيچيده مي شوند و اين امر، منجر به نيروهاي لاندن بين مولکولي قويتر مي شود. الماس
الماس کربن خالص ، الماس همان کربن معمولی است که در فشرده ترین حالت ممکن قرار میگیرد. کربن، یکی از معمولی ترین عناصر جهان است و در تمام کیهان میتوان ردی از ان پیدا کرد. کربن همچنین یکی از چهار عنصر اصلی برای پیدایش و ادامه حیات است. ۱۸ درصد بدن از کربن تشکیل شده است. هوایی هم که تنفس میکنیم حاوی دی اکسید کربن است و بیشتر مواد غذایی ترکیبات کربن دارند. در حالت خالص کربن معمولا در ۳ شکل یافت میشود . الماس: که یک بلور شفاف و بسیار سخت است. گرافیت: ماده ای معدنی که از کربن خالص تهیه میشود و بسیار نرم و سیاه رنگ است. ساختار مولکولی ان به فشردگی الماس نیست و به همین دلیل از الماس ضعیف تر است فولریت: جدید ترین شکل مولکول کربن که ۱۳ سال از شناخته شدن ان نمی گذرد. این ماده معدنی دقیقا از ۶۰ اتم کربن تشکیل شده است که یک کره کامل را شکل میدهند. الماس در حدود ۱۶۰ کیلومتری زیر پوسته زمین . درون صخره های مذاب جبه تشکیل مشوند. در این بخش از زمین فشار و حرارت به قدری است که فرایند تبدیل کردن به الماس میتواند صورت پذیرد. حداقل شرایط این فرایند. دمای ۴۰۰ درجه سانتیگراد و فشار ۳۰ هزار اتمسفر ( هر اتمسفر . فشار هوا در سطح دریا است ) است . اندکی پایین تر از این شرایط، گرافیت تولید میشود. شرایط تولید الماس در عمق ۱۵۰ کیلومتری زیر پوسته زمین مهیاست، جایی که فشار به ۵۰ هزار اتمسفر و دما به ۱۲۰۰ درجه سانتیگراد میرسد. فوران های قوی گدازه ای، این الماس ها را به سطح زمین اورده و انها مجراهای کیمبرلیت را تشکیل دادند ( کیمبرلیت نام مکانی در افریقای جنوبی است که این مجراها برای نخستین بار در ان کشف شد ) بسیاری از این فوران ها در فاصله یک میلیارد تا ۲۰ میلیون سال پیش صورت گرفت. این جریان های گدازه ای که به مراتب از فوران های اتشفشانی امروز شدیدتر بودند و از اعماق بیشتری سر چشمه گرفتند، درون این مجراهای کیمبرلیت سرد شدند و رگه های مخروطی شکل صخره ای کیمبرلیت را تشکیل دادند که الماس ها را نیز در برداشت . کیمبرلیت صخره آبی رنگی است که معدنچیان الماس آن را جستجو میکنند. سطح این مجراهای کیمبرلیت از ۲ تا ۱۴۶ هکتار است. در بستر رودخانه ها هم می توان الماس پیدا کرد. این مناطق را نواحی الماس آبرفتی می نامند. در واقع منشاء این الماس ها نیز همان مجرای کیمبرلیت است. ولی مجموعه ای از فعالیت های جغرافیایی موجب شد آنها از مکان خود حرکت کنند و به سطح زمین برسند. امروزه در کشورهای استرالیا ، بروئنی، برزیل، روسیه، و برخی کشورهای آفریقایی مانند آفریقای جنوبی و کنگو . معادن الماس مشغول به کار است. الماسی که از معدن به دست می آید سطحی ناهموار و خشن دارد و برای تبدیل شدن به یک ( یا چند ) قطعه جواهر با ارزش باید بریده شده و صیقل داده شود. سختی الماس همان طور که گفتیم الماس سخت ترین ماده طبیعی است. البته دانشمندان توانسته اند الماس هایی مصنوعی بسازند که به مراتب از خویشاوندان طبیعی خود سخت ترند. در الماس، اتمهای کربن در یک ساختار مشبک قرار دارند. بدین شکل که هر اتم الکترون های خود را با ۴ اتم دیگر به اشتراک میگذارد و یک واحد ۴ وجهی را تشکیل می دهد. این مجموعه ۴ وجهی که از ۵ مولکول تشکیل شده است یک مولکول فوق العاده قوی را تشکیل میدهد. اما هر ۵ اتم مجاور می توانند چنین شبکه ای را تشکیل دهند. به همین دلیل، بلور الماس تا بدین حد مستحکم است. اما در گرافیت، اتمهای کربن در یک حلقه به یکدیگر متصل میشوند؛ یعنی هر اتم فقط به یک اتم دیگر متصل است و به همین دلیل آن قدر نرم است. زغال و مغز مداد، نمونه های بارز گرافیت هستند . تراش الماس روشهای بخصوصی برای تراش الماس و فرستادن آن به جواهر فروشی ها وجود دارد که این ۴ تکنیک را شامل میشود. ۱) شکافتن: برای جدا کردن ناخالصی ها و ناهماهنگی های موجود در الماس، سنگ الماس زبر روی یک سطح صاف و مناسب بتونی قرار میگیرد. سپس با استفاده از لیزر، یا یک الماس دیگر، یک شیار تیز درون الماس ایجاد می شود. این شیار روی ضعیف ترین صفحات ملکولی بلور، یعنی جهت هایی که پیوند میان اتمها ضعیف تر است، ایجاد میشود سپس، یک تیغه فولادی در شیار قرار داده میشود وبا یک ضربه سریع و محکم . سنگ را به ۲ بخش تقسیم میکند. سپس سنگهای جدا شده از سطح بتونی برداشته میشوند. ۲) اره کردن: برخی اوقات که الماس باید در راستای یک صفحه ترک یا بریدگی، شکافته شود، نمی توان در مرحله نخست یعنی شکافتن به نتیجه رسید. در این حالت، از یک تیغه فسفر – برنز ، که با سرعت ۱۵ هزار دور در دقیقه می چرخد. استفاده میشود و در عملیات اره کردن به آرامی در راستای مطلوب پیش می رود. بتازگی از لیزر نیز در این عملیات استفاده میشود. ۳) خشک کردن: الماس روی یک دستگاه تراش بسته می شود و الماس دیگری روی آن حرکت می کند تا نمای کلی و زبر کمر بند الماس را ایجاد کند، یعنی حاشیه بیرونی الماس در بیشترین قطر خود. ۴) صیقل دادن: در این مرحله الماس، شکل نهایی خود را میگیرد. الماس را به بازویی که بر فراز چرخ گردان صیقل است قرار میدهند. این چرخ با پودر الماس پوشیده شده است و هنگامی که الماس بر سطح آن فشار داده می شود . سطوح زبر آن را نرم کرده رفته رفته آن را صیقل می دهند. معیارهای برتری الماس زیبایی یک الماس بر اساس معیارهای مختلفی مورد قضاوت قرار میگیرد. بسیاری از الماس ها هرگز به ویترین جواهر فروشی ها نمی رسند؛ زیرا بیش از اندازه معیوبند. آنها را معمولا برای مصارف صنعتی استفاده میکنند. مثلا در لبه های دریل هایی که در معادن الماس کاربرد دارند و یا در تراش و برش دیگر الماس های خام. ۴ معیار مهم برای تعین زیبایی الماس مورد استفاده قرار می گیرد: ۱) برش: این خصوصیت به چگونگی برش الماس و خصوصیات هندسی آن بازمی گردد . هنگامی که الماس برش میخورد . برهای مختلف آن به وجود میاید و شکل نهایی الماس تعین می شود . ۲) صافی: این خصلت، معیاری از ترک های الماس است، یا دیگر اجرامی که ممکن است درون آن دیده شوند. درجه بندی صافی از بدون ترک آغاز می شود و سپس به بسیار بسیار ناچیز و تا حدودی ناخالص نزول میکند. ۳) قیراط : قیراط واحد وزن الماس است . هر قیراط در حدود ۲۰۰ میلی گرم است. ۴) رنگ: در خصوص الماس های شفاف، مقیاس رنگ از d تا z تغیر می کند. بدین ترتیب که از سفید یخی شروع می شود که رنگ بیشتر الماس های گران قیمت است و به زرد روشن خاتمه می یابد. دیگر معیار های ارزیابی الماس عبارتند از : شفافیت، درخشندگی و پراکندگی نور. الماسی که صد در صد کربن باشد، کاملا شفاف خواهد بود . اما معمولا الماس ها عناصر دیگری نیز دارند که بر رنگ آن ها تاثیر می گذارد . از اینها گذشته الماس های آبی، قرمز، سیاه، صورتی، بنفش و سبز تیره نیز وجود دارند که بسیار بسیار نادر هستند. چرا الماس تا بدین حد درخشان است ؟ الماس فشرده ترین ماده شفاف جهان است که تا کنون شناخته شده است. ضریب شکست آن 12/2 است . یعنی سرعت نور درون آن کمتر از نصف سرعت معمولی خود می شود .اما همین فشردگی است که باعث میشود الماس درخشنده ترین جسم شفاف باشد و برق بزند. چون سطح الماس با یکدیگر زاویه های بزرگی میسازند. بنابراین وقتی پرتویی از یکی از آنها وارد میشود. چند بار بازتاب میشود. الماس های مشهور دنیا کالینان : بزرگترین الماسی است که تاکنون یافت شده است. این الماس ۳۱۶۰ قیراطی سال ۱۹۰۵ در ترانسوال آفریقای جنوبی ساخته شد . سال ۱۹۰۷، این الماس به پادشاه انگلستان، ادوارد هفتم اهدا شد و بعد ها به ۹ سنگ بزرگ و تعدادی سنگ کوچک تقسیم شد. مهمترین آنها الماس ۲/۵۳۰ قیراطی ستاره آفریقا است که در عصای شاهی کار گذاشته شده و در برج لندن به نمایش درآمده است. سلطان بزرگ : به نظر می رسد سومین الماس بزرگ غیر بریده شده ای است که تاکنون یافت شده است. این الماس سال ۱۶۵۰ کشف شد و وزن سنگش ۵۰/۷۸۷ قیراط بود، اما فقط به یک قطعه ۲۸۰ قیراطی بریده شد. این الماس به نام شاه جهان، سازنده تاج محل نامیده شد. متاسفانه این الماس به شکل عجیبی مفقود شده است و از مکان امروزی آن اطلاعی در دست نیست. امید آبی : مشهورترین الماس آمریکا است . این جواهر ۵۲/۴۵ قیراطی تاریخچه ای ۴۰۰ ساله دارد در آن زمان قطعه سنگی ۱۸۷۵/۱۱۲ قیراطی بود و سال ۱۶۶۸، به و سیله شاه لوئیس چهاردهم در فرانسه خریداری شد. به نظر می رسد این جواهر نایاب در معدن کلار هند یافت شده باشد. تغییرات بار موثر هسته در یک تناوب از جدول و یا در یک گروه : در هر دو مسیر یعنی از چپ به راست و از بالا به پایین بار موثر هسته افزایش می یابد دانلود کتاب درسی شیمی 2 . |
|||||||||||||
|
|
||
|
|
||
اوربیتال اتمی
از نظر لغوی ، اوربیتال به معنای خانه الکترون میباشد و ناحیهای است که احتمال یافتن الکترون در آن زیاد است. معادله شرودینگر پایه مکانیک موجی است. این معادله بر حسب یک تابع موجی (ψ) برای الکترون نوشته میشود. از حل معادله شرودینگر اتم هیدروژن یک سلسله جواب به عنوان تابع موج بدست میآید. تابع موج ناحیهای در اطراف هسته را نشان میدهد که در آن ناحیه ، احتمال یافتن الکترون وجود دارد. تابع موجی یک الکترون ، آنچه را که اوربیتال نامیده میشود، توصیف میکند.
مقدمه
اوربیتال محدودهای از فضای اطراف هسته میباشد که احتمال یافتن الکترون در آن وجود دارد. این احتمال در نزدیکی هسته بیشترین مقدار را دارد. ولی برای تمام نقاطی از فضا که فاصله معینی از هسته دارند، احتمال معینی وجود دارد. هر اوربیتال میتواند حداکثر دو الکترون را در خود جای دهد. دو الکترونی که در یک اوربیتال جای میگیرند، دارای اسپین مخالف هستند.
هر الکترون را میتوان با چهار عدد کوانتومی مشخص کرد که به منزله شناسنامه الکترون هستند و فاصله نسبی الکترون از هسته (n) ، لایه فرعی و شکل اوربیتال (L) ، جهت گیری اوربیتال در فضا (s) را بیان میکنند. بر اساس اصل طرد پاولی در یک اتم هیچ دو الکترونی را نمیتوان یافت که تمام چهار عدد کوانتومی آنها یکسان باشد.
تاریخچه
در مورد ساختمان اتم و نحوه قرار گرفتن الکترونها و پروتونها در آن بررسیهای زیادی توسط دانشمندان انجام شده و نظریههای مختلفی ارائه شده است. تامسون اتم را به شکل کرهای یکنواخت از بارهای مثبت تا شعاع 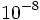 تصور میکرد که بارهای منفی در محیط خارجی کره پراکندهاند. رادرفورد در سال 1911 با استفاده از ذرات آلفا دلایل قانع کنندهای مبنی بر وجود هسته اتم ارائه داد. او اتم را بصورت کره ای تصور میکرد که هسته در وسط آن قرار دارد و الکترونها به فواصل نسبی بینهایت زیاد در خارج از هسته قرار دارند. نیلز بوهر در سال 1913 نظریه ساختمان الکترونی اتم را پیشنهاد کرد.
تصور میکرد که بارهای منفی در محیط خارجی کره پراکندهاند. رادرفورد در سال 1911 با استفاده از ذرات آلفا دلایل قانع کنندهای مبنی بر وجود هسته اتم ارائه داد. او اتم را بصورت کره ای تصور میکرد که هسته در وسط آن قرار دارد و الکترونها به فواصل نسبی بینهایت زیاد در خارج از هسته قرار دارند. نیلز بوهر در سال 1913 نظریه ساختمان الکترونی اتم را پیشنهاد کرد.
این نظریه بر اساس مدل اتمی رادرفورد ، نظریه کوانتومی پلانک و دادههای تجربی حاصل از مطالعه طیفهای اتمی قرار داشت، و بیان میکرد که الکترون اتم هیدروژن فقط میتواند در مدارهای کروی معین (مدارها یا ترازهای انرژی) که بطور متحدالمرکز دور هسته قرار دارند، وجود داشته باشد. این مدارها تابع محدودیت کوانتومی است. شرودینگر در سال 1926 با طرح معادلهای که در آن محدودیت کوانتومی انرژی الکترون و تصور الکترون بصورت موج ساکن ، با هم تلفیق شده بود، تابع موجی الکترون (ψ) را معرفی کرد که مختصات مکان الکترون در فضایی که الکترون در آن یافت میشود و انرژی الکترون از لحاظ ریاضی را به هم مربوط کرد.
اگر الکترون را بصورت ذرهای در حال حرکت به دور هسته در نظر بگیریم، ψ2 متناسب با احتمال یافتن الکترون در جزو معینی از فضاست و احتمال یافتن الکترون در ناحیهای که ابر الکترونی غلیظتر باشد بیشتر است.
تفسیر مکانیکی اوربیتال
شدت هر موج با مجذور دامنه آن متناسب است. تابع موجی (ψ) ، تابع دامنه است. مجذور دامنه یا مجذور تابع موجی برای یک حجم کوچک در هر موقعیتی از فضا با چگالی بار الکترونیهسته گسترده شده است. این ابر در برخی نواحی غلیظتر از برخی نواحی دیگر است.
احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظتر باشد، بیشتر خواهد بود. این تفسیر کوششی برای توصیف مسیر الکترون به عمل نمیآورد، بلکه فقط پیشبینی میکند که احتمال یافتن الکترون در کجا بیشتر است.
از نظر مکانیک کوانتومی هیچ محدودیتی برای وجود الکترون در فضا اطراف هسته وجود ندارد. پس بینهایت اوربیتال وجود دارد.
در آن حجم متناسب است. میتوان تصور کرد که بار الکترونی به سبب حرکت سریع الکترون بصورت ابر باردار در فضای دور اعداد کوانتومی
مکانیک موجی که نظریه شرودینگر اساس آن میباشد با استفاده از چهار عدد کوانتومی وضعیت الکترون را توصیف میکند. این اعداد عبارتند از :
عدد کوانتومی اصلی
این عدد نشاندهنده ترازهای انرژی است که الکترونها در آن ترازها به دور هسته گردش میکنند و عدد صحیحی میباشد. این عدد میتواند کلیه مقادیر اعداد صحیح مثبت به استثنای صفر را قبول کند.
عدد کوانتومی اندازه حرکت زاویهای مداری
آرنولد زمر فیلد در سال 1916 پیشنهاد کرد که هر مدار بوهر (n) با شرط n>1 از لایههایی فرعی با اختلاف انرژی کم تشکیل شدهاست. به هر لایه فرعی یک عدد کوانتومی (L) نسبت داده میشود. این عدد نشان دهنده شکل هندسی توزیع تابع احتمال پیدا کردن الکترون در فضای اطراف هسته میباشد وکلیه مقادیر L=0,1,2, … , n-1 را اختیار کند.
عدد کوانتومی مغناطیسی مداری
تعداد اوربیتالهای یک تراز فرعی را میتوان از این عدد استنتاج کرد که در اثر میدان مغناطیسی هر تراز L به این ترازها شکافته میشود. بعنوان مثال میدان مغناطیسی بر اوربیتال کروی S که با عدد L=0 مشخص میشود، تاثیری ندارد چون S تقارن کروی دارد و در تمام جهتها بطور یکسان تحت تاثیر خطوط نیرو قرار میگیرد. این عدد که با m نشان داده می شود، مقادیر ممکن این عدد عبارتند از :
عدد کوانتومی مغناطیسی اسپینی
این عدد مشخص کننده حرکت تقدیمی الکترون است و با Ms نشان داده میشود و میتواند مقادیر 2/1+ , 2/1- را اختیار کند.
ابر الکترونی و مکان الکترون
در مورد یک الکترون در حالت n=1 هیدروژن ، ابر باردار بالاترین چگالی را در نزدیکی هسته دارد و بتدریج که فاصله از هسته افزایش مییابد، رقیقتر میشود. احتمال یافتن الکترون در حجم کوچکی از فضا ، در نزدیکی هسته ، بیشترین مقدار را دارد و با افزایش فاصله از هسته به سمت صفر میل میکند.
لایههای کروی بسیار نازکی را که یکی پس از دیگری بطور متحدالمرکز به دور هسته قرار دارند، تصور کنید. احتمال یافتن الکترون در واحد حجم فضای نزدیک به هسته بیشترین مقدار خود را دارد. ولی در عوض یک لایه نزدیک به هسته ، در مقایسه با لایههای دورتر ، تعداد کمتری واحد حجم را در بر میگیرد. احتمال شعاعی هر دو این عوامل را با هم به حساب میآورد.
نمودار سطح مرزی
احتمال یافتن الکترون در تمام نقاطی که از هسته به فاصله a0 برابر مقداری است که از طریق نظریه بور برای شعاع لایه n=1 تعیین شده است. در نظریه بوهر ،a0 فاصلهای است که همواره الکترون لایه n=1 از هسته دارا است. در مکانیک موجی a0 فاصلهای از هسته است که الکترون در آن حضور بیشتری دارد.
از آنجا که اصولا در هر فاصله معین از هسته ، الکترون امکان حضور دارد، ترسیم ناحیهای با مرز مشخص که احتمال 100 درصد وجود الکترون را در بر بگیرد، ناممکن است. اما میتوان سطح مرزی را ترسیم کرد که بتواند نقاط با احتمال یکسان را به هم بپیوندد و در برگیرنده حجمی باشد که در آن ، احتمال یافتن الکترون زیاد و مثلا در حدود 90 درصد است. چنین شکلی که نمودار سطح مرزی نامیده میشود، برای الکترون اتم هیدروژن در حالت n=1 بصورت کروی میباشد.
انواع اوربیتال
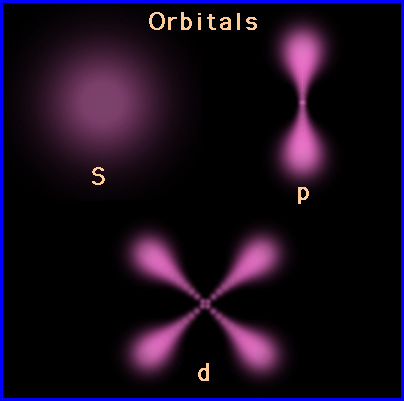
اوربیتال S
اوربیتالهای S دارای تقارن کروی میباشد، تراز n=1 حداکثر دارای دو الکترون است. بنابراین تراز فرعی 1S و 2S و 3S و… هم تقارن کروی دارند، با این تفاوت که اندازه آنها بزرگتر از اوربیتال 1S میباشد.
اوربیتال p
اوربیتال p از سه اوربیتال فرعی تشکیل شده است. هر اوربیتال p به شکل دو کره تغییر شکل یافته است که میتوان آنها را در امتداد یکی از محورهای سه

![]() تبادل
لینک هوشمند
تبادل
لینک هوشمند
![]()
برای تبادل
لینک ابتدا ما
را با عنوان
شیمی2 و
آدرس
chem2.LXB.ir
لینک
نمایید سپس
مشخصات لینک
خود را در زیر
نوشته . در صورت
وجود لینک ما در
سایت شما
لینکتان به طور
خودکار در سایت
ما قرار میگیرد.